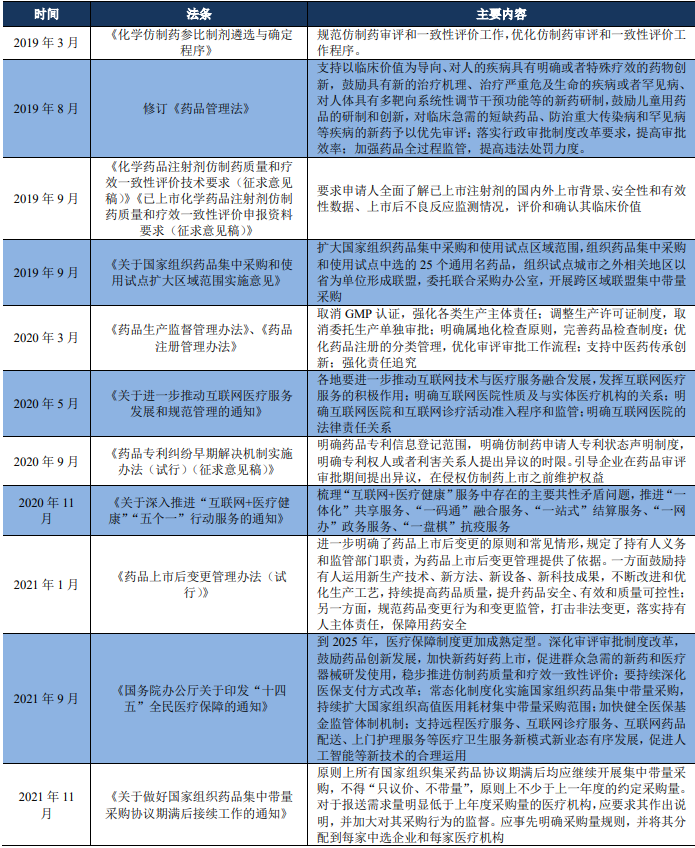
2019年3月《化学仿制药参比制剂遴选与确定程序》规范仿制药审评和一致性评价工作,优化仿制药审评和一致性评价工作程序。
2019年8月修订《药品管理法》支持以临床价值为导向、对人的疾病具有明确或者特殊疗效的药物创新,鼓励具有新的治疗机理、治疗严重危及生命的疾病或者罕见病、对人体具有多靶向系统性调节干预功能等的新药研制,鼓励儿童用药品的研制和创新,对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评;落实行政审批制度改革要求,提高审批效率;加强药品全过程监管,提高违法处罚力度。
2019年9月《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》要求申请人全面了解已上市注射剂的国内外上市背景、安全性和有效性数据、上市后不良反应监测情况,评价和确认其临床价值。
2019年9月《关于国家组织药品集中采购和使用试点扩大区域范围实施意见》扩大国家组织药品集中采购和使用试点区域范围,组织药品集中采购和使用试点中选的25个通用名药品,组织试点城市之外相关地区以省为单位形成联盟,委托联合采购办公室,开展跨区域联盟集中带量采购。
2020年3月《药品生产监督管理办法》、《药品注册管理办法》取消GMP认证,强化各类生产主体责任;调整生产许可证制度,取消委托生产单独审批;明确属地化检查原则,完善药品检查制度;优化药品注册的分类管理,优化审评审批工作流程;支持中医药传承创新;强化责任追究。
2020年5月《关于进一步推动互联网医疗服务发展和规范管理的通知》各地要进一步推动互联网技术与医疗服务融合发展,发挥互联网医疗服务的积极作用;明确互联网医院性质及与实体医疗机构的关系;明确互联网医院和互联网诊疗活动准入程序和监管;明确互联网医院的法律责任关系。
2020年9月《药品专利纠纷早期解决机制实施办法(试行)(征求意见稿)》明确药品专利信息登记范围,明确仿制药申请人专利状态声明制度,明确专利权人或者利害关系人提出异议的时限。引导企业在药品审评审批期间提出异议,在侵权仿制药上市之前维护权益。
2020年11月《关于深入推进“互联网+医疗健康”“五个一”行动服务的通知》梳理“互联网+医疗健康”服务中存在的主要共性矛盾问题,推进“一体化”共享服务、“一码通”融合服务、“一站式”结算服务、“一网办”政务服务、“一盘棋”抗疫服务。
2021年1月《药品上市后变更管理办法(试行)》进一步明确了药品上市后变更的原则和常见情形,规定了持有人义务和监管部门职责,为药品上市后变更管理提供了依据。一方面鼓励持有人运用新生产技术、新方法、新设备、新科技成果,不断改进和优化生产工艺,持续提高药品质量,提升药品安全、有效和质量可控性;另一方面,规范药品变更行为和变更监管,打击非法变更,落实持有人主体责任,保障用药安全。
2021年9月《国务院办公厅关于印发“十四五”全民医疗保障的通知》到2025年,医疗保障制度更加成熟定型。深化审评审批制度改革,鼓励药品创新发展,加快新药好药上市,促进群众急需的新药和医疗器械研发使用,稳步推进仿制药质量和疗效一致性评价;要持续深化医保支付方式改革;常态化制度化实施国家组织药品集中带量采购,持续扩大国家组织高值医用耗材集中带量采购范围;加快健全医保基金监管体制机制;支持远程医疗服务、互联网诊疗服务、互联网药品配送、上门护理服务等医疗卫生服务新模式新业态有序发展,促进人工智能等新技术的合理运用。
2021年11月《关于做好国家组织药品集中带量采购协议期满后接续工作的通知》原则上所有国家组织集采药品协议期满后均应继续开展集中带量采购,不得“只议价、不带量”,原则上不少于上一年度的约定采购量。对于报送需求量明显低于上年度采购量的医疗机构,应要求其作出说明,并加大对其采购行为的监督。应事先明确采购量规则,并将其分配到每家中选企业和每家医疗机构。
文本由@-YANYI 整理发布于三个皮匠报告网站,未经授权禁止转载。

 0731-84720580
0731-84720580
 商务合作:really158d
商务合作:really158d


 友链申请 (QQ):1737380874
友链申请 (QQ):1737380874





 微信扫码登录
微信扫码登录





