全球首款新冠口服药获批上市
11月4日,默沙东/Ridgeback宣布,英国药品和保健产品监管局(MHRA)已在英国批准莫努匹韦(molnupiravir)上市,用于治疗重症和住院风险较高的轻至中度COVID-19成人患者。Molnupiravir是全球第一个获批用于治疗成人轻度至中度COVID-19的口服抗病毒药物。
据悉,最初Molnupiravir是针对委内瑞拉马脑炎病毒的药物,研究发现其对SARS、MERS等冠状病毒有效,后转化成为新冠特效药。当前,Molnupiravir由默沙东和Ridgeback公司共同开发,Ridgeback从默沙东获得了首付款,未来还将基于临床开发和注册进展获得里程金。两家公司未来将平分药物销售后的利润。
莫努匹韦Molnupiravir意义何在?
莫努匹韦Molnupiravir可以用于暴露前或暴露后预防,减少病毒/感染潜在传播,对免疫应答缺乏的患者进行治疗,同时口服药物比抗体药物给药更加便捷、可及性强、产能限制更小、社会成本更低。
莫努匹韦Molnupiravir药物介绍
Molnupiravir是默沙东和Ridgeback合作开发的一款小分子新冠口服药。Molnupiravir通过诱导RNA复制过程中发生错配突变,从而抑制子代功能性病毒的产生。
2021年10月1日,Molnupiravir公布了针对轻症非住院患者的临床试验MOVe-OUT的积极中期数据,Molnupiravir
相比安慰剂降低了50%的住院/死亡率。基于这项积极数据,默沙东于2021年10月11日向FDA提交了紧急使用授权(EUA)申请,欧盟EMA也正在考虑对Molnupiravir启动滚动审评。
莫努匹韦Molnupiravir作用机理
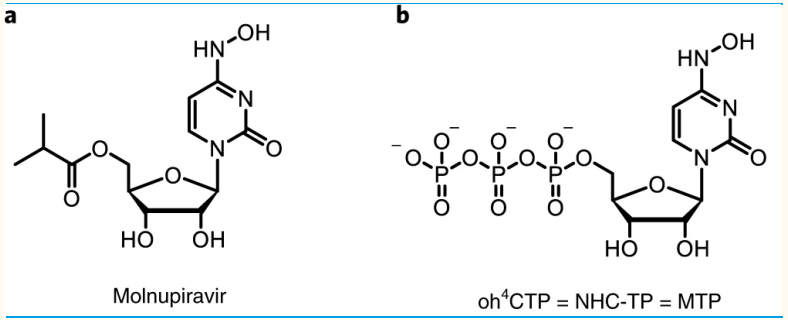
Molnupiravir是NHC(核糖核苷类似物N4-羟基胞苷,N4-hydroxycytidine,NHC)的异丙酯前药,进入体内后水解为NHC,NHC进一步磷酸化,转化为MTP。
Molnupiravir分子结构图
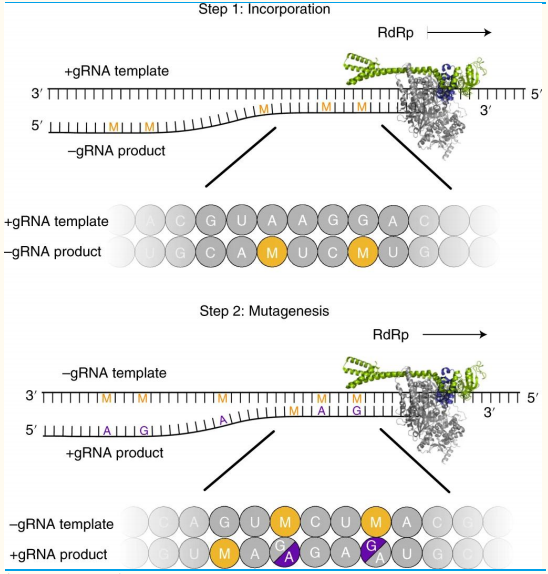
目前研究认为,在MTP存在的情况下,新冠病毒的RNA依赖性RNA聚合酶(RdRp)在复制正链基因组RNA模板时,可以将M核苷酸取代C或U纳入负链基因组或亚基因组RNA。获得的含有M的负链RNA可作为模板,进一步复制为正链RNA和正链mRNA,而在复制中,一方面M核苷酸有机会再次取代C或U核苷酸,另一方面已经在模板链中的M可能会配对A碱基,也可能会配对G碱基。由于M核苷酸能同时匹配A碱基或G碱基,打破了遗传物质复制过程中A-U配对和G-C配对的一一对应原则,因此发生错配的可能性大大提高。值得注意的是,这种错配并不会导致RNA复制过程的停止,即并不干扰RdRp的功能,RdRp还是会继续完成RNA复制,但是预计复制出来的这些RNA产物会发生错配突变,无法翻译出病毒所需的蛋白,因此不支持功能性病毒的形成。
Molnupiravir诱导病毒RNA突变
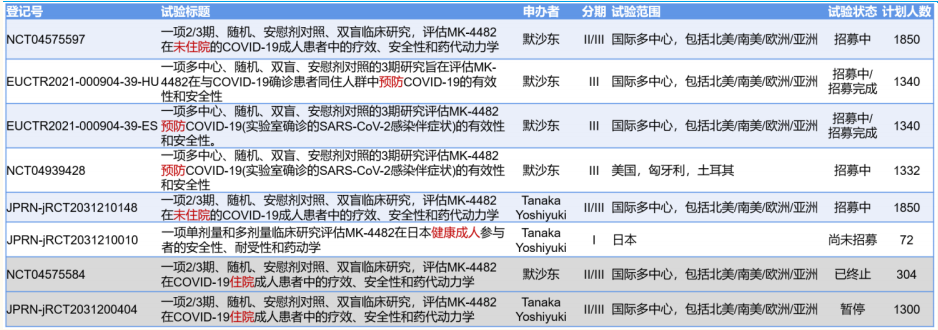
Molnupiravir 开展的主要临床试验一览
小分子CDMO
小分子药物的生产过程大致可以分成以下几个阶段:偏精细化工阶段(nonGMP)→RSM(nonGMP)→GMP
中间体、高级中间体→API(GMP)→制剂(GMP)。
过去15-20年时间,国内头部的CDMO企业不断实现国际医药创新高端制造供应链上的突破,国际认可度持续提升,D(Development)和
M(Manufacture)的产品不断升级(RSM→GMP中间体→GMP 高级中间体→API)。
参考我们对口服新冠药物稳态市场规模的分析和小分子创新药制造产业链的价值链切分,我们预计完整的口服新冠药物制造环节空间较大,中国境内口服新冠药物的高级中间体、原料药CDMO订单有望快速放量。
小分子创新药制造产业链示意图

数据来源:《国金证券-医药健康行业新冠系列专题深度(二):Q4窗口期,看好新冠口服药物及其CDMO投资机遇》

 0731-84720580
0731-84720580
 商务合作:really158d
商务合作:really158d


 友链申请 (QQ):1737380874
友链申请 (QQ):1737380874





 微信扫码登录
微信扫码登录





